Implementera snabbt konstruktioner för flödescytometri med hjälp av datainsamlingsmoduler med hög noggrannhet
Bidraget med av DigiKeys nordamerikanska redaktörer
2022-04-21
Flödescytometri används ofta av kliniker och diagnostiker för att analysera cellers egenskaper. De utvärderar optiskt proteinnivåer, blodhälsa, granularitet och cellstorlek, m.m, en cell i taget. Även om det är mycket känsliga system är konstruktörerna av cytometrar under ständig press att påskynda analystiden, vilket kräver nya metoder för både flödescytometri och tillhörande elektronik.
Cytometrar utsätter enskilda celler för laserljus för att skapa spridda och fluorescerande signaler. För att snabbt och exakt fånga upp ljuset och omvandla det till digitala signaler krävs en lavinfotodiod (APD) och komplicerad elektronik. Kretsarna för denna process kan ta lång tid att konstruera och implementera, särskilt med tanke på att insamlingssystem för flödescytometri kräver utrustning med hög hastighet och lågt brus för att säkerställa systemets noggrannhet.
För att på ett kostnadseffektivt sätt stödja snabbare analyser med flödescytometri kan konstruktörer lösa problemen med hastighet och noggrannhet med en datainsamlingslösning som består av interna drivförstärkare och en analog-till-digitalomvandlare (ADC).
Artikeln visar kortfattat hur system för flödescytometri fungerar. Därefter presenteras ADAQ23878, en 18-bitars ADC-modul från Analog Devices, och man visar hur den kan användas för att konstruera ett steg för detektering och konvertering i flödescytometrar. Ett tillhörande utvärderingspaket kommer också att introduceras.
Moderna principer för flödescytometri
Modern flödescytometri är en automatiserad process som analyserar cell- och ytmolekyler, karakteriserar och definierar olika celltyper i en heterogen cellpopulation. Utan att räkna med förberedelsetiden, som kan vara mer än en timme, utför instrumentet en bedömning av tre till sex egenskaper hos 10 000 enskilda celler på mindre än en minut.
För att möjliggöra detta är flödescytometrins steg för förberedelse av enskilda celler avgörande. Organiseringen av proverna sker i en hydrodynamisk skiktvätska för att fokusera celler eller partiklar till en smal provström med en enda rad av celler för analys. Vid denna omvandling måste de enskilda cellerna behålla sina naturliga biologiska egenskaper och biokemiska komponenter.
Figur 1 visar ett diagram över ett instrument för flödescytomtri som börjar från början med ett prov med flera celler.
 Figur 1: Diagram över en flödescytometer, från skiktfokusering till datainsamling. (Bildkälla: Wikipedia, ändrad av Bonnie Baker)
Figur 1: Diagram över en flödescytometer, från skiktfokusering till datainsamling. (Bildkälla: Wikipedia, ändrad av Bonnie Baker)
Flödescytometerns sex huvudkomponenter är en flödescell, en laser, en lavinfotodiod (APD), en transimpedansförstärkare (TIA), en ADC och en dator för datainsamling och analys.
Flödescytometern har en vätskeström eller en skiktvätska som görs smalare för att transportera och rikta in cellerna i en enda rad genom ljusstrålen. Laserljuset fångar en cell i taget och skapar en FSC-signal (forward-scattered light) och en SSC-signal (side-scattered light). Det fluorescerande ljuset sorteras med hjälp av speglar och filter och förstärks sedan av en APD.
Nästa steg är att detektera, digitalisera och analysera ljuset efter att det har träffat APD:n. För detektering är FET-ingångsoperationsförstärkaren LTC6268 på 500 megahertz (MHz) med extremt låg förström, lågt spänningsbrus från Analog Devices perfekt för den TIA med hög hastighet som krävs för detektering.
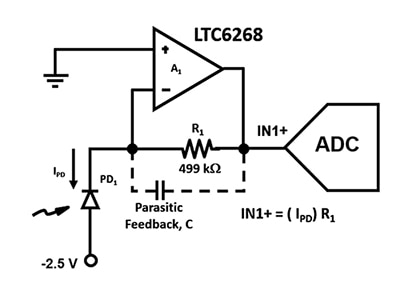 Figur 2: TIA-kretsen använder en APD (PD1) och en FET-operationsförstärkare med låg ingångsström för att omvandla extremt låga fotodiodströmmar till en utgångsspänning vid IN1+. (Bildkälla: Bonnie Baker)
Figur 2: TIA-kretsen använder en APD (PD1) och en FET-operationsförstärkare med låg ingångsström för att omvandla extremt låga fotodiodströmmar till en utgångsspänning vid IN1+. (Bildkälla: Bonnie Baker)
Det är viktigt att konstruera denna förstärkarkrets med största möjliga bandbredd, så parasitära kapacitanser måste minimeras. Till exempel påverkar den parasitära återkopplingskapacitansen, C, stabiliteten och bandbredden i figur 2. Oavsett val av resistorpaket kommer det alltid att finnas en parasitär kapacitans i förstärkarens återkopplingsväg. En 0805-kapsling, som har ett längre avstånd mellan ändstyckena och den lägsta parasitära kapacitansen, är dock att föredra för tillämpningar med hög hastighet.
Att öka avståndet mellan ändstyckena för R1 är inte det enda sättet att minska kapacitansen. Ett annat sätt att minska kapaciteten från platta till platta är att skydda de E-fältvägar som ger upphov till den parasitära kapacitansen genom att placera en extra jordbana under motståndetR1 (figur 3).
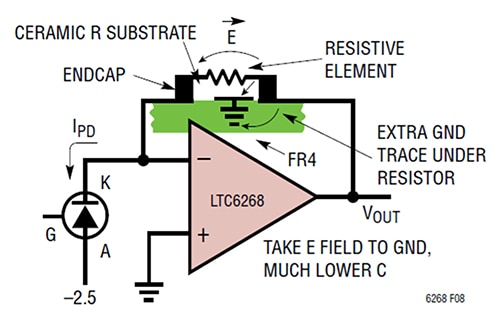 Figur 3: Genom att lägga till en jordbana under återkopplingsresistorn förbikopplas E-fältet bort från återkopplingssidan och leds ner till jord. (Bildkälla: Analog Devices)
Figur 3: Genom att lägga till en jordbana under återkopplingsresistorn förbikopplas E-fältet bort från återkopplingssidan och leds ner till jord. (Bildkälla: Analog Devices)
I det här fallet innebär metoden specifikt att man placerar en kort jordbana under och mellan resistorplattorna i närheten av TIA:ns utgångssida. Denna teknik ger en parasitkapacitet på 0,028 pF med en TIA-bandbredd på 1/(2π*RF*CPARASITIC), vilket motsvarar 11,4 MHz.
De optiska ljussignalerna är riktade mot flera lavindioder med lämpliga optiska filter. APD-, TIA- och ADC-systemet omvandlar dessa signaler till en digital representation och skickar data till mikroprocessorn för vidare analys.
Moderna instrument har vanligtvis flera lasrar och APD:er. De nuvarande kommersiella enheterna har tio lasrar och trettio lavinfotodioder. Genom att öka antalet lasrar- och fotomultiplikatordetektorer kan flera antikroppsmärkningar användas för att exakt identifiera målpopulationer med hjälp av fenotypiska markörer.
Hur snabbt analysen går beror dock på en fin balans mellan:
- Skiktvätskans hastighet.
- Förmågan hos den hydrodynamiska fokuseringsprocessen att bilda rader av enstaka celler.
- Tunnelns diameter
- Förmågan att bevara en cells integritet.
- Elektroniken
Flödescytometrins akustiska fokusering
Även om flera lasrar och APD:er påskyndar analysen och identifieringen, kan de senaste moderna metoderna för flödescytometri av enstaka celler i bästa fall samla in data om upp till en miljon enskilda celler per minut. I många tillämpningar, t.ex. för att upptäcka cirkulerande tumörceller i blodet med så låga nivåer som 100 celler per milliliter, är detta inte tillräckligt. I kliniska tillämpningar för sällsynta celler kräver testerna regelbundet tidskrävande analyser av miljarder celler.
Alternativet till den hydrodynamiskt fokuserade cellberedningsprocessen är en akustisk fokuseringsprocess. Här fästs ett piezoelektriskt material, t.ex. blyzirkonattitanat (PZT), på en glaskapillär för att omvandla elektriska pulser till mekaniska vibrationer (figur 4a). Genom att använda en PZT för att vibrera glaskapillärens sidoväggar vid den rektangulära flödescellens resonansfrekvens genererar systemet en mängd olika akustiska stående vågor med varierande antal trycknoder.
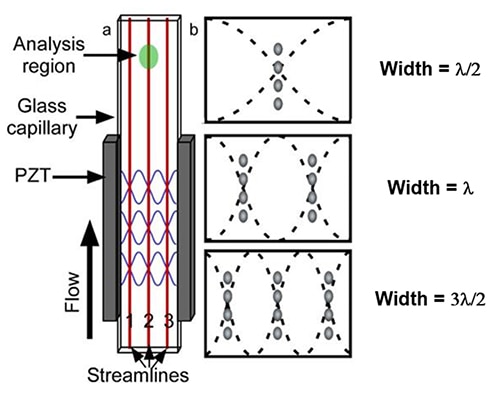 Figur 4: Bild på en akustisk flödescell som tillverkats med en rektangulär glaskapillär.(a). Placeringen av de tre första trycknoderna för en kapillär med fast bredd (b). (Bildkälla: National Center for Biotechnology Information)
Figur 4: Bild på en akustisk flödescell som tillverkats med en rektangulär glaskapillär.(a). Placeringen av de tre första trycknoderna för en kapillär med fast bredd (b). (Bildkälla: National Center for Biotechnology Information)
Dessa PZT-frekvensnoder anpassar flödande partiklar i flera diskreta strömlinjer (figur 4b). Den akustiska flödescellen använder en linjär, stående akustisk våg för att ställa in olika våglängder genom att skapa en eller flera övertoner. Enligt den enkla linjära modellen med stående vågor bildar cellerna i provet enstaka eller många encellsrader i flödeskammaren.
Med denna exakta organisering av cellerna kan skiktvätskans tunnel vidgas för att möjliggöra snabbare flöden förbi laserstrålen (figur 5).
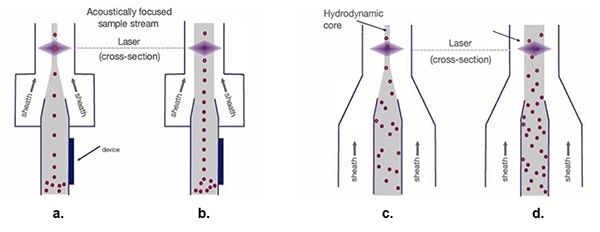 Figur 5: Med den hydrodynamiska provströmmen (c. och d.), när skiktvätskans bredd ökar sprids cellproverna, vilket försvårar den optiska mätningen. Akustiskt fokuserade provströmmar (a. och b.) bibehåller cellerna i en enda rad oavsett skiktvätskans bredd. (Bildkälla: Thermo Fischer Scientific)
Figur 5: Med den hydrodynamiska provströmmen (c. och d.), när skiktvätskans bredd ökar sprids cellproverna, vilket försvårar den optiska mätningen. Akustiskt fokuserade provströmmar (a. och b.) bibehåller cellerna i en enda rad oavsett skiktvätskans bredd. (Bildkälla: Thermo Fischer Scientific)
Traditionell hydrodynamisk fokusering (figur 5c.) arrangerar de encelliga raderna som förberedelse för laserskanning. Även om en bredare tratt för provströmmens kärna möjliggör en högre hastighet för materialet i skiktvätskan (figur 5d), resulterar det även i en spridning av den enskilda cellorganisationen, vilket ger signalvariation och försämrad datakvalitet.
Akustisk fokusering (figur 5a.) placerar biologiska celler och andra partiklar i en smal rad, även med en bredare tunnel. Denna exakta celljustering möjliggör högre provtagningshastigheter samtidigt som datakvaliteten bibehålls (figur 5b).
I praktiken ökar flödescytometriens akustiska fokusering frekvensen för cellprovtagning med ~20x (figur 6).
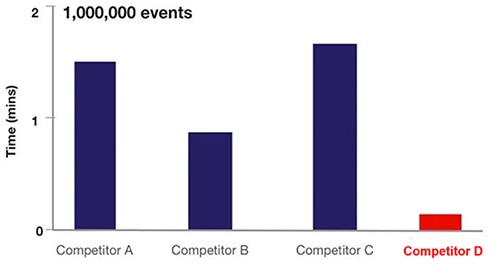 Figur 6: Jämförelse av provtagningstiden för olika utrustningar för flödescytometri baserat på flödescytometri med vätska (A, B, C) jämfört med akustisk fokuseringscytometri (D). (Bildkälla: Thermo Fischer Scientific)
Figur 6: Jämförelse av provtagningstiden för olika utrustningar för flödescytometri baserat på flödescytometri med vätska (A, B, C) jämfört med akustisk fokuseringscytometri (D). (Bildkälla: Thermo Fischer Scientific)
I figur 6 använder utrustning från A, B och C hydrodynamisk teknik, medan D använder flödesmetoden akustisk fokusering av cytometri.
Akustisk fokusering av flödescytometri för insamling av data
Utformningen av elektroniken för flödescytometriutrustning med akustisk fokusering kräver elektronik för fotoavkänning med hög hastighet för att kunna hantera blodets celler och skiktvätskans hastighet genom munstycket med större diameter. LTC6268 med hög hastighet på 600 MHz som nämndes tidigare, i kombination med en specialiserad 0805-kapslingslayout för resistorpaketet, ökar den optiska avkänningshastigheten till 11,4 MHz (Figur 7, vänster). Utgången från LTC6268 matas till en ADC ADAQ23878 från Analog Devices för digitalisering.
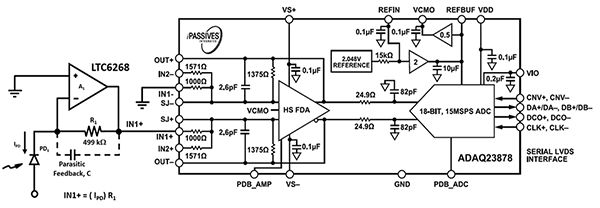 Figur 7: ADC:n ADAQ23878 digitaliserar den optiska signalen från fotodioden (PD1) och TIA-kretsen (vänster). (Bildkälla: Bonnie Baker)
Figur 7: ADC:n ADAQ23878 digitaliserar den optiska signalen från fotodioden (PD1) och TIA-kretsen (vänster). (Bildkälla: Bonnie Baker)
ADAQ23878 är ett 18-bitars, noggrant höghastighetssystem i paket (SIP) med 15 megasamplar per sekund (MSPS) för datainsamling. Den minskar kraftigt utvecklingscykeln för precisionsmätningssystem genom att överföra designbördan av val av komponenter för ingångsdrivning, optimering och layout från konstruktören till enheten.
Det modulära tillvägagångssättet med SIP minskar antalet komponenter i slutsystemet genom att kombinera flera gemensamma signalbehandlings- och bearbetningsblock i en enda enhet, tillsammans med den snabba 18-bitars ADC:n med 15 MSPS successivt approximationsregister (SAR). Blocken inkluderar en differentiell ADC-drivförstärkare med lågt brus, och en stabil referensbuffert.
ADAQ23878 innehåller även viktiga passiva komponenter som använder tekniken iPassive från Analog Devices för att minimera temperaturberoende felkällor och optimera prestandan. ADC:s drivsteg med snabb fastställelsetid bidrar till dess förmåga att garantera en snabb datainsamling.
Utvärdering av µModulen ADAQ23878
För att att utvärdera ADAQ23878 tillhandahåller Analog Devices utvärderingskortet EVAL-ADAQ23878FMCZ (figur 8). Kortet demonstrerar prestandan hos μModulen ADAQ23878 och är ett mångsidigt verktyg för att utvärdera en front-end design för flödescytometri och en mängd andra tillämpningar.
 Figur 8: Utvärderingskortet EVAL-ADAQ23878FMCZ för ADAQ23878 har strömkretsar på kortet, levereras med tillhörande programvara för styrning och dataanalys och är SDP-H1-kompatibelt. (Bildkälla: Analog Devices)
Figur 8: Utvärderingskortet EVAL-ADAQ23878FMCZ för ADAQ23878 har strömkretsar på kortet, levereras med tillhörande programvara för styrning och dataanalys och är SDP-H1-kompatibelt. (Bildkälla: Analog Devices)
Utvärderingskortet EVAL-ADAQ23878FMCZ kräver en persondator med Windows 10 eller senare, en precisionssignalkälla med lågt brus och ett bandpassfilter som lämpar sig för 18-bitars testning. Utvärderingskortet behöver plugin-programmet ACE och SPD-H1-drivrutinen för ADAQ23878.
Sammanfattning
Undersökningen av en biologisk cell i taget med hjälp av standardmetoder för flödescytometri med hydrodynamiskt fokus har varit framgångsrik, men med behovet av snabbare analyser har man övergått till tekniker baserade på akustiska flödesmetoder med fokus. Elektroniken som stöder mer avancerad flödescytometri måste dock också förbättras, samtidigt som utrymme, kostnad och utvecklingstid minimeras.
Som visas kan operationsförstärkaren LTC6268 med hög hastighet och den noggranna datainsamlingslösningen μModule ADAQ233878 med hög hastighet, kombineras för att skapa ett komplett datainsamlingssystem för avancerad utrustning för flödescytometri.

Disclaimer: The opinions, beliefs, and viewpoints expressed by the various authors and/or forum participants on this website do not necessarily reflect the opinions, beliefs, and viewpoints of DigiKey or official policies of DigiKey.







